आवर्त सारणी – Periodic Table In Hindi
Periodic Table In Hindi
परिचय (Introduction)
Periodic Table In Hindi (आवर्त सारणी) एक ऐसी व्यवस्था है जिसमें सभी ज्ञात रासायनिक तत्वों को उनके बढ़ते हुए परमाणु क्रमांक (atomic number) के अनुसार और उनके रासायनिक गुणों के आवर्ती पैटर्न के अनुसार रखा गया है।
इस व्यवस्था से तत्वों के गुणों में प्रवृत्ति (जैसे इलेक्ट्रोनगेटिविटी, आयनीकरण ऊर्जा, परमाणु त्रिज्या आदि) को आसानी से समझा जा सकता है।
आवर्त सारणी (Periodic Table) विज्ञान के अध्ययन में एक महत्वपूर्ण उपकरण है। इसमें तत्वों को period (line) और Group (column) में बांटा जाता है, जिससे तत्वों के set-up और उनकी समानताओं का पता चलता है।
Mendeleev द्वारा 1869 में प्रस्तावित प्रारंभिक आवर्त सारणी से लेकर आज तक 118 तत्वों को सम्मिलित करके आधुनिक सारणी विकसित की गई है, जो रसायन और भौतिकी में एक महान खोज मानी जाती है।
इतिहास (History of Periodic Table)
आवर्त सारणी के विकास में अनेक वैज्ञानिकों का योगदान रहा है। तत्वों के वर्गीकरण के लिए शुरुआती प्रयास 1789 में हुआ, जब एंटोनी लवोसीए (Antoine Lavoisier) ने तत्वों को धातु, अधातु, गैस आदि में विभाजित किया।
1829 में जोहान डोबरेनर (Johann Döbereiner) ने Li, Na, K जैसी तत्वों की तीन-तीन समूहों (त्रियाँ) की पहचान की, और पाया कि बीच वाले तत्व का गुण समान अनुपात में दूसरे दो के गुणों से ज्ञात किया जा सकता है।
1862 में शैन्कॉर्टोइस (Chancourtois) ने तत्वों को एक सिलेंडर पर 16 के अंतर से व्यवस्थित कर पहला आवर्ती क्रम (telluric screw) दिखाया।
- 1789: लवोसीए ने तत्वों को धातु, अधातु, गैस आदि श्रेणियों में वर्गीकृत किया।
- 1829: डोबरेनर ने तत्वों की त्रियों (triads) की खोज की, जैसे Li–Na–K, और बीच के तत्व की विशेषताओं को गणितीय रूप से अनुमानित किया।
- 1862: A.B. De Chancourtois ने तत्वों को एक त्रि-आयामी स्पाइरल पर रखते हुए ‘टेलेट्यूरिक स्क्रू’ प्रपत्र दिया, जिससे समान गुण वाले तत्व ऊर्ध्वाधर रेखा में संरेखित होते दिखे।
- 1865-1866: जॉन न्यूलैंड्स (John Newlands) ने “ऑक्टेव नियम” प्रस्तावित किया – हर आठवां तत्व रासायनिक गुणों में समानता दिखाता है।
- 1869: डिमित्रि मेंडेलीव (Dmitri Mendeleev) ने तत्वों को बढ़ते परमाणु भार के क्रम में व्यवस्थित करते हुए आधुनिक आवर्त सारणी की नींव रखी। उन्होंने कुछ अज्ञात तत्वों के लिए रिक्त स्थान छोड़े और उनके गुण भविष्यवाणी करके सारणी की मजबूती दिखाई।
- 1890 के दशक: विलीअम रामसे (William Ramsay) द्वारा नए नोबेल गैसों की खोज ने साबित किया कि ये गैसें समूह-18 (निष्क्रिय गैसें) बनाएँगी और आवर्त सारणी की अवधि संख्या आठ बनी।
- 1913: हेनरी मौस्ले (Henry Moseley) ने रेंटजन विकिरण द्वारा परमाणु संख्या मापकर पाया कि तत्वों की सही क्रमबद्धता परमाणु भार की तुलना में परमाणु संख्या (प्रोटॉन की संख्या) द्वारा होती है। इससे अंततः आवर्त सारणी को प्रोटॉन संख्या के आधार पर व्यवस्थित किया गया।
इन चरणों के बाद आवर्त सारणी को क्रांतिकारी रूप से विकसित किया गया। Mendeleev की सारणी ने तत्वों के गुणों के आवर्ती क्रम को उजागर किया और कई अज्ञात तत्वों की भविष्यवाणी की।
1913 में मौस्ले के कार्य ने परमाणु संरचना को समझाया और सारणी को पूर्णता प्रदान की। आज भी आवर्त सारणी विज्ञान में दो सदी से अधिक का विकास दर्शाती है।
आवर्त सारणी के समूह (Periodic Table Groups)
आधुनिक आवर्त सारणी में कुल 18 समूह होते हैं, जो Vertical Columns के रूप में होते हैं। किसी समूह के सभी तत्वों के बाहरी (वालेंस) इलेक्ट्रॉनों की संख्या समान होती है, जिसके कारण उनके रासायनिक गुण भी समान रहते हैं।
उदाहरण के लिए, समूह 1 के सभी तत्वों में एक बाहरी इलेक्ट्रॉन होता है, समूह 2 में दो इलेक्ट्रॉन होते हैं, और समूह 18 में पूर्ण बाहरी कक्ष (पूरे इलेक्ट्रॉनों वाली परत) होता है।
अब हम प्रत्येक समूह की विशेषताओं को देखते हैं:
समूह 1: क्षार धातु (Alkali Metals)
समूह 1 के तत्व (Li, Na, K, Rb, Cs, Fr) एक बाहरी इलेक्ट्रॉन (ns¹) वाले नरम धातु होते हैं। ये बहुत सक्रिय होते हैं, विशेषकर पानी के साथ तीव्र प्रतिक्रिया करते हैं जिससे मजबूत क्षार (सल्फाइड्स या हाइड्रोक्साइड्स) बनते हैं। इनके गलनांक और क्वथनांक अपेक्षाकृत कम होते हैं।

- मुख्य विशेषताएँ: एक बाहरी इलेक्ट्रॉन, अत्यधिक प्रतिक्रियाशील, अस्थिर धातुएँ, जल (या अम्ल) से तीव्र प्रतिक्रिया। उदाहरण: NaCl (नमक) बनाना।
- रूप व उपयोग: शुद्ध अवस्था में नायट्रोजन गुब्बारे (balloons) में नहीं पाये जाते, हमेशा यौगिकों (जैसे सल्फेट, क्लोराइड आदि) में पाये जाते हैं। सोडियम, पोटेशियम आदि हमारी दैनिक रसोई के नमक के मुख्य घटक हैं।
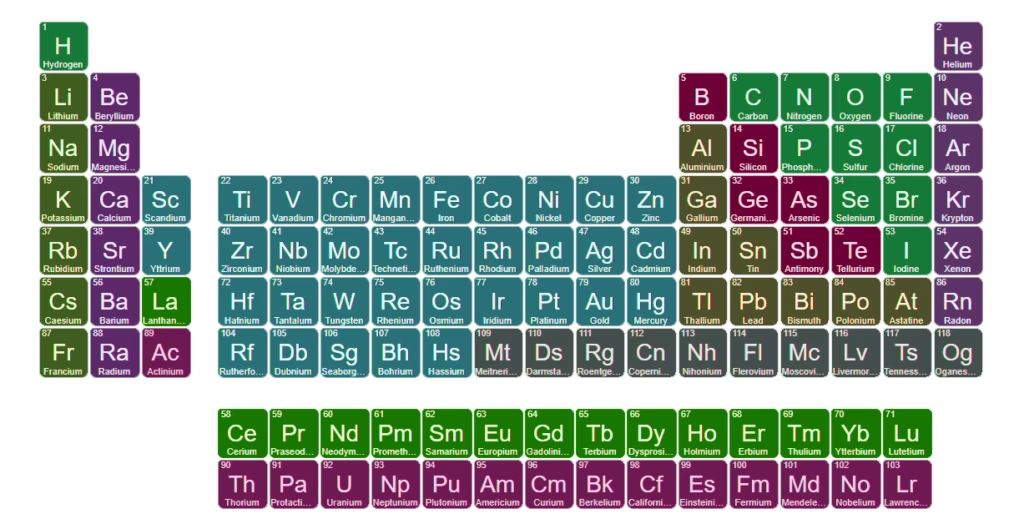
समूह 2: क्षारीय पृथ्वी धातु (Alkaline Earth Metals)
समूह 2 के तत्व (Be, Mg, Ca, Sr, Ba, Ra) दो बाहरी इलेक्ट्रॉन (ns²) वाले नरम धातु होते हैं। ये समूह 1 के धातुओं से थोड़ा कम सक्रिय होते हैं। ठोस अवस्था में इनका आवर्तक्रम कठोर होता है और गलनांक ऊँचा होता है।
ये भी ऊष्मा एवं विद्युत के अच्छे चालक होते हैं और सामान्यतः +2 ऑक्सीडेशन अवस्था में यौगिक बनाते हैं।
- मुख्य विशेषताएँ: दो बाहरी इलेक्ट्रॉन, ऑक्सीकरण अवस्था +2, क्षारीय गुण वाले धातु। भारी तत्व (Ca, Sr, Ba, Ra) समूह-1 की तुलना में भी प्रतिक्रियाशील होते हैं।
- रूप व उपयोग: कैल्शियम और मैग्नीशियम पृथ्वी की सतह और समुद्रों में प्रचुर मात्रा में मिलते हैं (चूना पत्थर, डोलोमाइट आदि). मैग्नीशियम का उपयोग विमान और यान में हल्के मिश्र धातुओं के लिए होता है। कैल्शियम का उपयोग निर्माण सामग्री (कंक्रीट) में होता है।
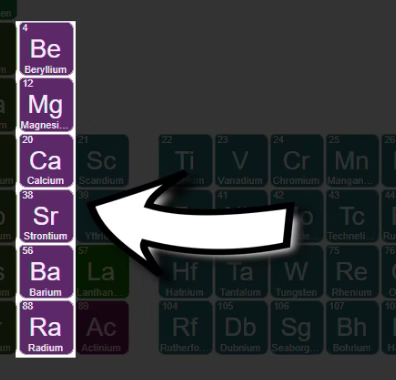
समूह 3: स्कैंडियम समूह (Scandium Group)
समूह 3 में स्कैंडियम (Sc), यट्रियम (Y), लैन्थेनम (La) और एक्टिनियम (Ac) आते हैं। ये संक्रमण धातु हैं जिनमें d-आर्बिटल में इलेक्ट्रॉन भरा जा रहा होता है।
इनका द्रव्यमान अपेक्षाकृत अधिक होता है और ये घने (high density), कठोर धातु होते हैं। स्कैंडियम मिश्र धातुओं (एलॉय) में उपयोगी है और यट्रियम अत्याधुनिक लेजर और इलेक्ट्रॉनिक्स में काम आता है।
लैन्थेनम तथा ऐक्टिनियम मूलतः लैंथनाइड एवं ऐक्टिनाइड श्रेणी के प्रथम तत्व हैं।
समूह 4: टाइटेनियम समूह (Titanium Group)
समूह 4 में टाइटेनियम (Ti), जिरकोनियम (Zr), हाफ़्नियम (Hf) और रदरफोर्डियम (Rf) शामिल हैं। ये सभी उच्च गलनांक वाले चमकीले संक्रमण धातु हैं।

टाइटेनियम हल्का परन्तु अत्यंत दृढ़ धातु है, जो जंग-रोधी गुणों के लिए जाना जाता है। इन्हें विमान, अंतरिक्ष यान, या चिकित्सा में हड्डी प्रत्यारोपण (इम्प्लांट) बनाने में उपयोग किया जाता है।
जिरकोनियम नाभिकीय रिएक्टरों में अपनी विकिरण-सहनशीलता के कारण उपयोगी है।
समूह 5: वैनडियम समूह (Vanadium Group)
समूह 5 में वैनाडियम (V), नियोबियम (Nb), टैंटालम (Ta) और डब्नियम (Db) आते हैं। ये भी उच्च गलनांक वाले संक्रमण धातु हैं।

वैनाडियम और टैंटालम जंग-रोधी मिश्र धातुओं और रासायनिक उपकरणों में उपयोग किए जाते हैं। टैंटालम के औद्योगिक संघटन जादा कीमत पर विद्युत अपघटित कैपेसिटर बनाने में हैं।
समूह 6: क्रोमियम समूह (Chromium Group)
समूह 6 में क्रोमियम (Cr), मोलिब्डेनम (Mo), वोल्फ्राम (W) और सिघ़ियरियम (Sg) शामिल हैं। ये बेहद कठोर और बहुत उच्च गलनांक वाले धातु हैं।

क्रोमियम का उपयोग आमतौर पर धातु सतहों को चमकदार और जंग-रोधी बनाने के लिए क्रोमातकरण में होता है। वोल्फ्राम (टंगस्टन) उच्च तापरोधी विद्युत फिलामेंट्स, बल्ब के फिलामेंट तथा वेल्डिंग इलेक्ट्रोड बनाने में है।
मोलिब्डेनम मुख्यतः स्टील के मिश्र धातुओं (superalloys) में जोड़ा जाता है ताकि कठोरता और ऊष्मा-प्रतिरोध बढ़े।
समूह 7: मैंगनीज समूह (Manganese Group)
समूह 7 में मैंगनीज (Mn), टेक्निशियम (Tc), रेनियम (Re) और बोड़ियम (Bh) हैं। मैंगनीज लोहे के स्टील में मिश्र धातु के रूप में, और रसायनों के जैव रिएक्टर में ऑक्सीकरण घटक के रूप में उपयोगी है।

टेक्निशियम रेडियोधर्मी है और चिकित्सा इमेजिंग (स्कैन) में ट्रेसर के रूप में प्रयोग होता है।
समूह 8: लोहे का समूह (Iron Group)
समूह 8 में लोहा (Fe), रुथेनीयम (Ru), ऑस्मियम (Os) और हसियम (Hs) आते हैं। ये चमकीले, मजबूत धातु हैं। लोहे की सबसे प्रमुख विशेषता है चुंबकीय गुण (लकवा, कोबाल्ट, निकेल के साथ फेरोमैग्नेटिक धातु), और इसे स्टील बनाने में उपयोग किया जाता है।

ऑस्मियम सबसे घना प्राकृतिक धातु है और रुथेनीयम ज्वलनरोधी संपर्क बनाने में काम आता है।
समूह 9: कोबाल्ट समूह (Cobalt Group)
समूह 9 में कोबाल्ट (Co), रोडियम (Rh), इरिडियम (Ir) और माइटनेरियम (Mt) हैं। कोबाल्ट शक्तिशाली मैग्नेट बनाने में (हार्ड डिस्क ड्राइव में), और सेरेमिक कांच के नीले रंग के नमूने में काम आता है।

रोडियम और इरिडियम ऑटोमोबाइल उत्सर्जन नियंत्रक घटकों तथा ज्वेलरी में उपयोग होते हैं।
समूह 10: निकेल समूह (Nickel Group)
समूह 10 में निकेल (Ni), पल्लेडियम (Pd), प्लेटिनम (Pt) और डार्मस्टेडियम (Ds) हैं। निकेल जस्ता मिश्र धातुओं में उपयोग होता है (जैसे एलायज़ेलांद उपकरण), और सबसे उच्च तापरोधी विद्युत प्रतिरोधक (एलॉय) बनाने में काम आता है।

प्लेटिनम और पल्लेडियम उत्कृष्ट उत्प्रेरक हैं: उदाहरण के लिए, ऑटोमोबाइल उत्सर्जन में स्वर्ण (Pt) और रोडियम (Rh) संयोजन उपयोगी है।
समूह 11: ताम्बा समूह (Copper Group)
समूह 11 में तांबा (Cu), चांदी (Ag), स्वर्ण (Au) और रोंटजेनीयम (Rg) आते हैं। इन्हें सिक्के बनाने वाले धातु भी कहा जाता है क्योंकि Cu, Ag, Au प्राचीन काल से मुद्रा के लिए उपयोग में रहे हैं।

चांदी सबसे अच्छा विद्युत चालक है, स्वर्ण अत्यंत जंग-रोधी है, और तांबा भी उत्कृष्ट चालक है।
समूह 12: जस्ता समूह (Zinc Group)
समूह 12 में जस्ता (Zn), कैडमियम (Cd), पारा (Hg) और कोपरनिशियम (Cn) शामिल हैं। Zn व मिश्र धातुओं की नालीकरण (galvanization) में उपयोगी है।

Cd और Hg विषैली धातुएँ हैं; Hg एकमात्र तरल धातु है जो सामान्य तापमान पर तरल रहता है।
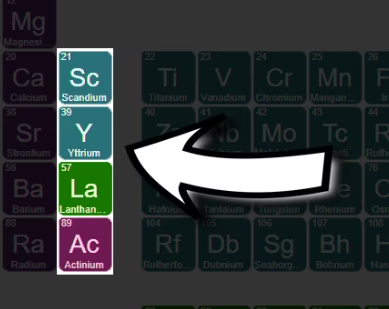
समूह 13: बोरोन समूह (Boron Group)
समूह 13 में बोरोन (B), एल्युमिनियम (Al), गैलिएम (Ga), इंडियम (In), थैलियम (Tl) और निहोनियम (Nh) हैं। B एक उपधातु है, बाकी धातुएँ हैं। इनमें तीन बाहरी इलेक्ट्रॉन (ns²np¹) होते हैं।
एल्युमिनियम हल्का, जंग-प्रतिरोधी धातु है और पैकेजिंग व निर्माण में बहुत उपयोगी है। गैलिएम और इंडियम अर्धचालक उपकरणों में काम आते हैं।
समूह 14: कार्बन समूह (Carbon Group)
समूह 14 में कार्बन (C), सिलिकॉन (Si), जर्मेनियम (Ge), टिन (Sn), सीसा (Pb) और फ्लेरोवियम (Fl) आते हैं। इनमें चार बाहरी इलेक्ट्रॉन (ns²np²) होते हैं।
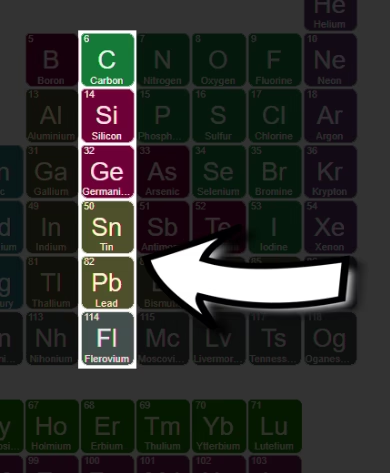
कार्बन एक प्रमुख गैर-धातु है जो सभी कार्बनिक यौगिकों का आधार है। सिलिकॉन और जर्मेनियम अर्धचालक हैं, जो आधुनिक इलेक्ट्रॉनिक्स के मूल हैं। टिन और सीसा भारी धातुएँ हैं जिनका उपयोग मिश्र धातुओं और रासायनिक यौगिकों में होता है।
समूह 15: नाइट्रोजन समूह (Nitrogen Group)
समूह 15 में नाइट्रोजन (N), फास्फोरस (P), आर्सेनिक (As), एंटिमनी (Sb), बिस्मथ (Bi) और मास्कोवियम (Mc) हैं। इनमें पांच बाहरी इलेक्ट्रॉन (ns²np³) होते हैं।

नाइट्रोजन एक अतिस्थिर गैस है; फास्फोरस उर्वरकों में उपयोग होता है। आर्सेनिक विषैला उपधातु है। बिस्मथ भारी धातु है जिसका उपयोग थर्मल कंवेंटरों में होता है।
समूह 16: ऑक्सीजन समूह (Oxygen Group/Chalcogens)
समूह 16 में ऑक्सीजन (O), सल्फर (S), सेलेनियम (Se), टेलुरियम (Te), पोलोनियम (Po) और लिवरमोरियम (Lv) आते हैं। इनमें छह बाहरी इलेक्ट्रॉन (ns²np⁴) होते हैं।
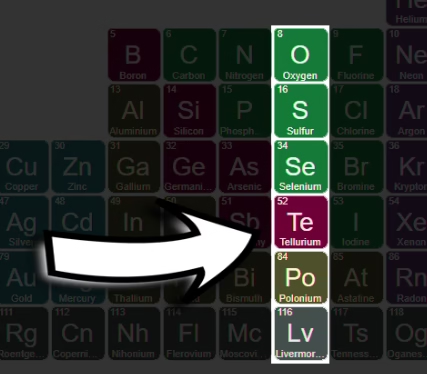
ऑक्सीजन अत्यधिक प्रतिक्रियाशील गैस है और जीवन के लिए आवश्यक है। सल्फर पीली रंग का गैर-धातु है और रबर को मजबूत बनाने (वुल्केनाइज़) में काम आता है। टेलुरियम और पोलोनियम रेडियोधर्मी हैं।
समूह 17: हलोजन (Halogens)
समूह 17 में फ्लोरीन (F), क्लोरीन (Cl), ब्रोमिन (Br), आयोडिन (I), एस्टैटिन (At) और टेनेसिन (Ts) शामिल हैं। ये सात बाहरी इलेक्ट्रॉन (ns²np⁵) वाले अत्यधिक प्रतिक्रियाशील अधातु गैसें हैं।

स्वभाव से ये इलेक्ट्रॉन ग्रहण करने वाली होती हैं और समूह 1 के क्षार धातुओं के साथ प्रतिक्रिया करके आम नमक (जैसे NaCl) बना देती हैं। उदाहरण के लिए, फ्लोरीन सबसे सक्रिय है, और आयोडिन का उपयोग कीटनाशकों, दवाओं और नारियल तेल के विरुद्ध कीटनाशक बनाने में होता है। एस्टैटिन एक दुर्लभ रेडियोधर्मी तत्व है।
समूह 18: निष्क्रिय गैस (Noble Gases)
समूह 18 में हीलियम (He), निऑन (Ne), आर्गन (Ar), क्रिप्टोन (Kr), जेनॉन (Xe), रैडॉन (Rn) और ओगनेसन (Og) हैं। इन तत्वों के बाहरी कक्ष पूर्ण इलेक्ट्रॉनों से भरे हुए होते हैं (He के पास 2 इलेक्ट्रॉन, बाकियों के पास 8), जिसके कारण ये अत्यंत रासायनिक रूप से निष्क्रिय होते हैं।
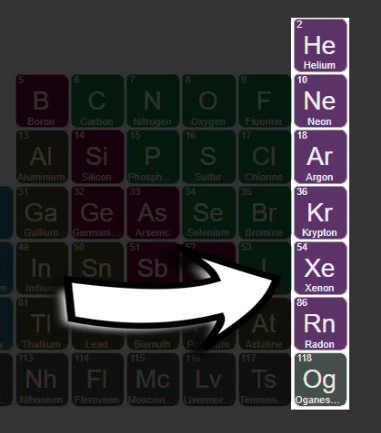
इन्हें पहले “जिन (inert) गैसें” कहा जाता था। इन गैसों का उपयोग प्रकाश बल्ब, लेज़र, तथा उन्नत चिकित्सा उपकरणों (MRI) में किया जाता है। उदाहरण के लिए, आर्गन का उपयोग मेटल वेल्डिंग में गैस कवच के रूप में होता है। रैडॉन प्राकृतिक रेडियोधर्मी है।
आवर्त सारणी के तत्वों की तालिका (Elements Table)
| तत्त्व का नाम (Element) | प्रतीक (Symbol) | परमाणु संख्या (Atomic Number) | समूह (Group) |
|---|---|---|---|
| हाइड्रोजन (Hydrogen) | H | 1 | 1 |
| हीलियम (Helium) | He | 2 | 18 |
| लिथियम (Lithium) | Li | 3 | 1 |
| बेरिलियम (Beryllium) | Be | 4 | 2 |
| बोरान (Boron) | B | 5 | 13 |
| कार्बन (Carbon) | C | 6 | 14 |
| नाइट्रोजन (Nitrogen) | N | 7 | 15 |
| ऑक्सीजन (Oxygen) | O | 8 | 16 |
| फ्लोरीन (Fluorine) | F | 9 | 17 |
| नियॉन (Neon) | Ne | 10 | 18 |
| सोडियम (Sodium) | Na | 11 | 1 |
| मैग्नीशियम (Magnesium) | Mg | 12 | 2 |
| एल्युमिनियम (Aluminum) | Al | 13 | 13 |
| सिलिकॉन (Silicon) | Si | 14 | 14 |
| फास्फोरस (Phosphorus) | P | 15 | 15 |
| सल्फर (Sulfur) | S | 16 | 16 |
| क्लोरीन (Chlorine) | Cl | 17 | 17 |
| आर्गन (Argon) | Ar | 18 | 18 |
| पोटैशियम (Potassium) | K | 19 | 1 |
| कैल्सियम (Calcium) | Ca | 20 | 2 |
| स्कैंडियम (Scandium) | Sc | 21 | 3 |
| टाइटैनियम (Titanium) | Ti | 22 | 4 |
| वैनडियम (Vanadium) | V | 23 | 5 |
| क्रोमियम (Chromium) | Cr | 24 | 6 |
| मैंगनीज (Manganese) | Mn | 25 | 7 |
| लोहा (Iron) | Fe | 26 | 8 |
| कोबाल्ट (Cobalt) | Co | 27 | 9 |
| निकल (Nickel) | Ni | 28 | 10 |
| कॉपर (Copper) | Cu | 29 | 11 |
| जिंक (Zinc) | Zn | 30 | 12 |
| गैलियम (Gallium) | Ga | 31 | 13 |
| जर्मेनियम (Germanium) | Ge | 32 | 14 |
| आर्सेनिक (Arsenic) | As | 33 | 15 |
| सेलेनियम (Selenium) | Se | 34 | 16 |
| ब्रोमिन (Bromine) | Br | 35 | 17 |
| क्रिप्टन (Krypton) | Kr | 36 | 18 |
| रूबिडियम (Rubidium) | Rb | 37 | 1 |
| स्ट्रॉन्शियम (Strontium) | Sr | 38 | 2 |
| इट्रियम (Yttrium) | Y | 39 | 3 |
| जिरकोनियम (Zirconium) | Zr | 40 | 4 |
| नियोबियम (Niobium) | Nb | 41 | 5 |
| मोलिब्डेनम (Molybdenum) | Mo | 42 | 6 |
| टेक्निशियम (Technetium) | Tc | 43 | 7 |
| रूथेनियम (Ruthenium) | Ru | 44 | 8 |
| रोडियम (Rhodium) | Rh | 45 | 9 |
| पल्लाडियम (Palladium) | Pd | 46 | 10 |
| चाँदी (Silver) | Ag | 47 | 11 |
| कैडमियम (Cadmium) | Cd | 48 | 12 |
| इंडियम (Indium) | In | 49 | 13 |
| टिन (Tin) | Sn | 50 | 14 |
| एंटीमनी (Antimony) | Sb | 51 | 15 |
| टेलुरियम (Tellurium) | Te | 52 | 16 |
| आयोडिन (Iodine) | I | 53 | 17 |
| ज़ेनॉन (Xenon) | Xe | 54 | 18 |
| सीज़ियम (Cesium) | Cs | 55 | 1 |
| बेरियम (Barium) | Ba | 56 | 2 |
| लैंथेनम (Lanthanum) | La | 57 | 3 |
| सेरियम (Cerium) | Ce | 58 | – |
| प्रासियोडाइमियम (Praseodymium) | Pr | 59 | – |
| नियोडाइमियम (Neodymium) | Nd | 60 | – |
| प्रौमेथियम (Promethium) | Pm | 61 | – |
| समैरियम (Samarium) | Sm | 62 | – |
| यूरोपियम (Europium) | Eu | 63 | – |
| गैडोलिनियम (Gadolinium) | Gd | 64 | – |
| टर्बियम (Terbium) | Tb | 65 | – |
| डिसप्रोसियम (Dysprosium) | Dy | 66 | – |
| होल्मियम (Holmium) | Ho | 67 | – |
| एर्बियम (Erbium) | Er | 68 | – |
| थुलियम (Thulium) | Tm | 69 | – |
| यित्तरबियम (Ytterbium) | Yb | 70 | – |
| लुटेटियम (Lutetium) | Lu | 71 | 3 |
| हाफ़्नियम (Hafnium) | Hf | 72 | 4 |
| टैंटलम (Tantalum) | Ta | 73 | 5 |
| वोल्फ्राम (W) | W | 74 | 6 |
| रीनियम (Rhenium) | Re | 75 | 7 |
| ऑस्मियम (Osmium) | Os | 76 | 8 |
| इरिडियम (Iridium) | Ir | 77 | 9 |
| प्लेटिनम (Platinum) | Pt | 78 | 10 |
| स्वर्ण (Gold) | Au | 79 | 11 |
| पारा (Mercury) | Hg | 80 | 12 |
| थैलियम (Thallium) | Tl | 81 | 13 |
| सीसा (Lead) | Pb | 82 | 14 |
| बिस्मथ (Bismuth) | Bi | 83 | 15 |
| पोलोनियम (Polonium) | Po | 84 | 16 |
| एस्टैटिन (Astatine) | At | 85 | 17 |
| रेडॉन (Radon) | Rn | 86 | 18 |
| फ्रैंसियम (Francium) | Fr | 87 | 1 |
| रेडियम (Radium) | Ra | 88 | 2 |
| ऐक्टिनियम (Actinium) | Ac | 89 | 3 |
| थोरियम (Thorium) | Th | 90 | – |
| प्रोटैक्टिनियम (Protactinium) | Pa | 91 | – |
| यूरेनियम (Uranium) | U | 92 | – |
| नीयूट्रोनियम (Neptunium) | Np | 93 | – |
| प्लूटोनियम (Plutonium) | Pu | 94 | – |
| अमेरिकियम (Americium) | Am | 95 | – |
| क्यूरीयम (Curium) | Cm | 96 | – |
| बर्केलियम (Berkelium) | Bk | 97 | – |
| कैलिफोर्नियम (Californium) | Cf | 98 | – |
| आइंस्टीनियम (Einsteinium) | Es | 99 | – |
| फर्मियम (Fermium) | Fm | 100 | – |
| मेंडेलवीयम (Mendelevium) | Md | 101 | – |
| नोबेलियम (Nobelium) | No | 102 | – |
| लॉरेंसियम (Lawrencium) | Lr | 103 | 3 |
| रदरफोर्डियम (Rutherfordium) | Rf | 104 | 4 |
| डब्नियम (Dubnium) | Db | 105 | 5 |
| सीबोर्गियम (Seaborgium) | Sg | 106 | 6 |
| बोोरियम (Bohrium) | Bh | 107 | 7 |
| हसियम (Hassium) | Hs | 108 | 8 |
| मेइटनेरियम (Meitnerium) | Mt | 109 | 9 |
| डार्मस्टेडियम (Darmstadtium) | Ds | 110 | 10 |
| रोंटजेनियम (Roentgenium) | Rg | 111 | 11 |
| कोपरनिशियम (Copernicium) | Cn | 112 | 12 |
| निहोनियम (Nihonium) | Nh | 113 | 13 |
| फ्लेरोवियम (Flerovium) | Fl | 114 | 14 |
| मॉस्कोवियम (Moscovium) | Mc | 115 | 15 |
| लिवरमोरियम (Livermorium) | Lv | 116 | 16 |
| टेनेसिन (Tennessine) | Ts | 117 | 17 |
| ओगनेसन (Oganesson) | Og | 118 | 18 |
आधुनिक उपयोग (Modern Usage of Periodic Table)
आधुनिक युग में आवर्त सारणी न केवल रसायन विज्ञान और भौतिकी का आधार है, बल्कि जीवविज्ञान, इंजीनियरिंग और तकनीकी अनुसंधान में भी इसका व्यापक उपयोग होता है। वैज्ञानिक जल्दी से किसी तत्व की मूलभूत जानकारी (जैसे रासायनिक प्रतीक, परमाणु भार) जानने के लिए आवर्त सारणी का सहारा लेते हैं।
इसके माध्यम से तत्वों के गुणों के रुझान और पैटर्न को पहचाना जा सकता है, जो नई दवाओं, सामग्री, और प्रौद्योगिकियों के विकास में सहायक होता है।
उदाहरण के लिए, चंदल कैंसर दवाओं में प्लेटिनम समूह के तत्व (प्लैटिनम) का उपयोग किया जाता है, और बैटरी तकनीक में लिथियम, निकेल, कोबाल्ट जैसे तत्व श्रेणीबद्ध तरीके से काम आते हैं।
आवर्त सारणी में तत्वों को समूहों में बांटने से समान गुण वाले तत्व एक साथ आ जाते हैं, जिससे बायोलॉजिकल इमेजिंग, पर्यावरण मॉनिटरिंग (भारी धातुओं की पहचान), और उत्प्रेरक (catalysts) विकास जैसे क्षेत्रों में योजनाबद्ध रूप से तत्वों का चयन किया जा सकता है।
आज आधुनिक आवर्त सारणी में कुल 118 तत्व सम्मिलित हैं। इसे वैज्ञानिकों की उपलब्धि माना जाता है जो 150 वर्षों से विकसित हो रही है। आवर्त सारणी की संरचना से रसायनज्ञ नए तत्वों की खोज और उनके संभावित गुणों का अनुमान पहले से ही लगा सकते हैं। इसके अलावा, आवर्त सारणी शैक्षिक संदर्भ में भी अतिमहत्वपूर्ण है – लगभग हर रसायन विज्ञान की पाठ्यपुस्तक में इसे विषय के आधार के रूप में शामिल किया जाता है।
विज्ञान क्या है? – What is Science
अक्सर पूछे जाने वाले प्रश्न (Frequently Asked Questions)
प्रश्न 1: आवर्त सारणी क्या है?
उत्तर: आवर्त सारणी एक ऐसी तालिका है जिसमें सभी रासायनिक तत्वों को बढ़ते हुए परमाणु क्रमांक के अनुसार रखा गया है।
प्रश्न 2: आवर्त सारणी किसने विकसित की थी?
उत्तर: आधुनिक आवर्त सारणी के विकास में कई वैज्ञानिकों ने योगदान दिया। हालांकि मेंडेलीव को अक्सर आवर्त सारणी का आविष्कारक कहा जाता है, उन्होंने 1869 में तत्वों की पहली व्यवस्थित तालिका प्रकाशित की। इससे पूर्व Lavoisier, Döbereiner, Newlands जैसी भूमिकाओं और बाद में Lothar Meyer एवं Henry Moseley जैसी वैज्ञानिकों ने भी तत्वों की व्यवस्थित समझ विकसित की। अंततः मौस्ले ने साबित किया कि तत्वों को परमाणु संख्या (प्रोटॉन संख्या) के आधार पर क्रमबद्ध करना सही है।
प्रश्न 3: आवर्त सारणी के समूह क्या होते हैं?
उत्तर: आवर्त सारणी के समूह (Groups) Vertical Columns होते हैं, जिनमें समान बाहरी इलेक्ट्रॉन संरचना वाले तत्व आते हैं।
प्रश्न 4: आधुनिक आवर्त सारणी में कुल कितने तत्व हैं?
उत्तर: 2025 तक आधुनिक आवर्त सारणी में कुल 118 ज्ञात तत्व शामिल किए गए हैं। इन तत्वों में सबसे ऊपर है हाइड्रोजन (Z=1) और सबसे नीचे है ओगनेसन (Z=118)।
प्रश्न 5: आवर्त सारणी का उपयोग क्यों महत्वपूर्ण है?
उत्तर: आवर्त सारणी का उपयोग वैज्ञानिकों और शिक्षकों के लिए अत्यंत महत्वपूर्ण है क्योंकि यह तत्वों की सूचना का केंद्रित स्रोत प्रदान करती है।
